|
这是转帖自台湾老师的文章,繁体字可能大家看不习惯,其实仔细看一下,发现繁体字其实是很好认的,一般我们认识简化字的都认识繁体字,因为繁体字里都有简化字的影子,而认识繁体字的不一定认识简化字,因为他们不知道是怎样简化的。所以大家不要头疼,仔细看下去,保证能看明白这篇文章。 化學示範實驗:自製乾電池(Dry Cell) 桃園縣私立復旦高級中學化學科陳淑媛老師/國立台灣大學化學系陳藹然博士責任編輯 我們在市面上很輕易的可以買到乾電池(碳鋅電池),不過由於電池被密封的關係,我們實際上無法觀察到它內部的結構。既然如此,我們就自己做一個簡單的乾電池吧。 一、實驗目的: 1. 了解市面上乾電池的原理。 2. 進行簡易電池的製作。 二、實驗原理: 乾電池(Dry cell)是在日常生活之中極為普遍使用輕便直流電源,可以使用於很多電器用品上如遙控器,電腦等,其中最常見的乾電池為碳鋅電池(Zinc-carbon dry cell or battery)。 以下為碳鋅電池的基本組成: 負極(陽極):鋅罐。\r 正極(陰極):碳棒。 電解液:以氯化銨或氯化鋅等鹽類水溶液作為電解液。並以二氧化錳與澱粉及電解質混合的混合劑 作為正極的作用物質。 圖一、乾電池的組成(1:金屬帽(+),2:石墨棒(正極),3:鋅外殼(負極),4:二氧化錳,5:潮濕的氯化銨糊狀液體(電解質),6:金屬末端(-))  乾電池放電時,鋅被氧化而釋放出電子,經由碳棒的傳遞,導致電解質NH4+ 離子還原,產生NH3與 H2。 半反應式如下: 陽極(負極):Zn → Zn2+ + 2e– 陰極(正極):2NH4+ + 2e– → 2NH3 + H2 釋出的氫再被二氧化錳所氧化: 2MnO2 + H2 → Mn2O3 + H2O 而氨被 Zn2+ 與 Cl– 吸收,形成安定的錯離子化合物: Zn2+ + 2NH3 + 2Cl– → Zn(NH3)2Cl2 #p#分页标题#e# 故電池的全反應為: Zn + 2NH4Cl + 2MnO2 → Zn(NH3)2Cl2 + Mn2O3 + H2O 三、實驗儀器及藥品: 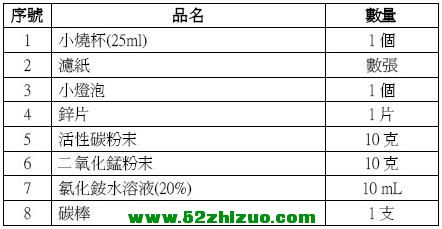 四、實驗步驟: 1. 將鋅片裁成適當大小,在鋅片的一端剪開一長為片寬的2/3的細條,將其向上折。將鋅片彎成圓筒狀,大小剛好能放入底片盒內。 2. 將二氧化錳粉末及活性碳粉依1:1.5~2的比例充分混合後,加入20%氯化鋅水溶液,呈現稍微濕潤的粉末混合物即可。 3. 濾紙裁成長條狀,寬度比鋅片的寬度多約三分之一,捲成筒狀,其半徑需比鋅片小。將步驟一的鋅片筒套在濾紙筒外,因為濾紙寬度比鋅片大,多出的部份向外反折將鋅片筒包住,再把包好濾紙的鋅筒放入底片盒中。\r 4. 將碳棒垂直放入盒的中央,在其周圍填入混合物,一定要裝滿壓實,可用鉛筆頭將混合物往下壓。 5. 用滴管加20%的氯化銨水溶液全面濕潤混合物(滴的量要控制在不令混合物成為黏稠狀),將高出於鋅筒的濾紙折入桶內壓實。自製碳鋅電池便完成。\r 實驗紀錄: 1. 外圍的鋅殼\r  2. 配製電解質  3.鋅片用濾紙隔絕電解質  4. 用鬧鐘測試自製的電池  #p#分页标题#e# #p#分页标题#e#(责任编辑:admin) |